Chimica | La legge di Charles o legge isobara
La relazione che descrive in che modo avviene la dilatazione di un gas, a pressione costante, è chiamata legge di Charles o legge isobara e venne formulata nel 1787 da Jacques Charles.
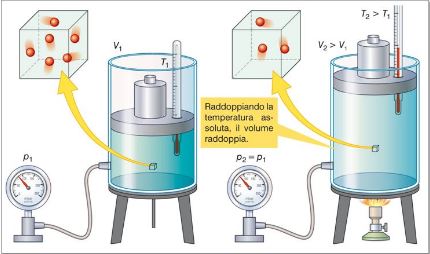
Il volume di una determinata quantità di gas, a pressione costante, è direttamente proporzionale alla sua temperatura assoluta. Il numero totale di particelle resta lo stesso, ma diminuisce il loro numero nell’unità di volume. Raddoppiando la temperatura assoluta, il volume raddoppia.
Poiché due grandezze sono direttamente proporzionali se il loro rapporto è costante, possiamo scrivere: V / T = k quando p = costante
Pertanto, innalzando la temperatura di un gas (a pressione costante) da T1 a T2, il suo volume aumenterà da V1 a V2 in modo che il rapporto tra volume e temperatura assoluta resti costante:
V1 / T1 = V2 / T2 = k