Chimica | Miscugli, elementi e composti
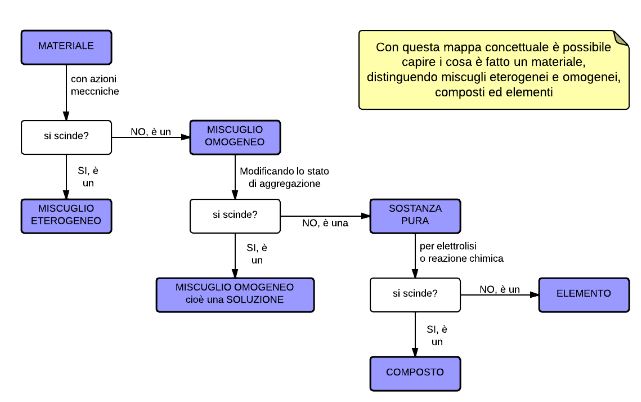
- Un sistema è una porzione delimitata di materia.
- Un sistema costituito da una sola fase è detto sistema omogeneo.
- Un sistema costituito da due o più fasi è detto eterogeneo.
- Un sistema si definisce puro se è formato da una singola sostanza.
- Un sistema formato da due o più sostanze è un miscuglio.
Una soluzione è un miscuglio di due o più sostanze fisicamente omogeneo. Il componente più abbondante della soluzione si chiama solvente, tutti gli altri si chiamano soluti. Molto spesso i miscugli non sono omogenei, ma eterogenei, perché costituiti da differenti parti (fasi) distinguibili l’una dall’altra. Nell’acqua di mare la fase solida (sabbia) e quella liquida si distinguono a occhio nudo; invece nel latte, che a occhio nudo appare uniforme, si osservano al microscopio minuscole goccioline di grasso immerse in un liquido trasparente. Un miscuglio eterogeneo è costituito da componenti chimicamente definiti e da fasi fisicamente distinguibili. I gas formano solo miscele omogenee. I liquidi possono formare un’unica fase, se miscibili (soluzione), o più fasi, se immiscibili. I solidi formano miscele omogenee solo nelle leghe metalliche.
I sistemi puri, cioè le singole sostanze, si ottengono in genere per separazione dei componenti di un miscuglio tramite procedimenti fisici, come la distillazione, la cristallizzazione o altri ancora.
I colloidi sono sistemi che hanno caratteristiche intermedie fra le soluzioni e i miscugli eterogenei, dai quali si differenziano per le dimensioni delle particelle disperse. Se queste hanno dimensioni comprese tra 10−6 e 10−9 m, il miscuglio è detto colloide, presenta la stessa stabilità delle soluzioni ed è caratterizzato da proprietà ottiche, meccaniche ed elettriche del tutto particolari.
Se le particelle disperse hanno dimensioni superiori a 1000 nm, tali da poter essere viste con un normale microscopio, il miscuglio viene chiamato sospensione. Una sospensione rimane tale fino a quando la si mantiene in agitazione perché le sue particelle tendono a sedimentare per effetto della forza di gravità. In un colloide, invece, le particelle sospese tendono a rimanere stabili e non precipitano neppure in assenza di agitazione.
Le diverse combinazioni possibili di agenti disperdenti e fasi disperse hanno nomi differenti; i principali colloidi prendono i seguenti nomi:
1. Sol: sistema formato da una fase solida dispersa in un liquido e in grado di essere versato come un liquido.
2. Gel: aumentando la concentrazione delle particelle solide disperse in un liquido, un sol può passare allo stato di gel, così chiamato perché presenta consistenza gelatinosa.
3. Emulsione: è un sistema caratterizzato dalla dispersione di un liquido in un altro liquido, come, per esempio, il latte e la maionese.
4. Aerosol: a seconda che le particelle disperse nel gas siano solide o liquide, si distinguono aerosol solidi (come il fumo) e aerosol liquidi (come la nebbia).
5. Schiuma: gas dispersi in un liquido.
6. Spugna: gas dispersi in un solido.
Le sostanze formate da componenti più semplici si chiamano composti; quelle non decomponibili in alcun modo si chiamano elementi.
Si definisce elemento una sostanza pura che non può essere trasformata, con gli ordinari mezzi fisici e chimici, in altre sostanze ancora più semplici.
Gli elementi di cui oggi abbiamo conoscenza sono 118; 89 sono presenti in natura, principalmente sotto forma di composti e raramente nella forma elementare, gli altri sono stati scoperti nel corso delle ricerche sull’energia atomica oppure sono stati ottenuti mediante reazioni nucleari. I chimici hanno stabilito l’uso di apposite abbreviazioni per indicare gli elementi. Tali abbreviazioni prendono il nome di simboli e sono costituite da una o due lettere, di cui la prima è maiuscola e l’altra, se c’è, è minuscola.
A partire dalle proprietà chimiche e fisiche riscontrate, è possibile distinguere tre classi fondamentali di elementi: metalli, non metalli e semimetalli. A queste classi, contraddistinte da un diverso colore nella Tavola periodica, si aggiunge quella dei gas nobili, che occupa l’ultima colonna a destra.
Tutti i composti, indipendentemente dalla loro natura, presentano una stessa proprietà: hanno una composizione ben definita e costante. Tramite l’analisi chimica è infatti possibile verificare che le percentuali in massa degli elementi che costituiscono un determinato composto sono sempre le stesse, indipendentemente dalla quantità di composto che si analizza e dal luogo in cui esso si trova; nella sostanza pura acqua, per esempio, le percentuali di idrogeno e ossigeno sono ben definite e non possono variare.
Si definisce composto ogni sostanza pura che può essere decomposta, con gli ordinari mezzi fisici e chimici, in altre sostanze pure più semplici. I composti hanno una composizione ben definita e costante.